

清源堂(医药)有限公司

东方医药网客服
025-57950697
所在地区:山东
主营行业:

品牌名称:
型号规格:
批准文号:H20030263
产品标签:
产品卖点:
销售渠道:医院和药店

 025-57950697
025-57950697
| 执行标准 | |
| 产品类别 | 西药产品 |
| 产品规格 | |
| 卫生许可证 | |
| 成份 | |
| 性状 | |
| 不良反应 | |
| 注意事项 | |
| 禁忌 | |
| 贮藏 | |
| 保质期 | |
| 备注 |
产品介绍:
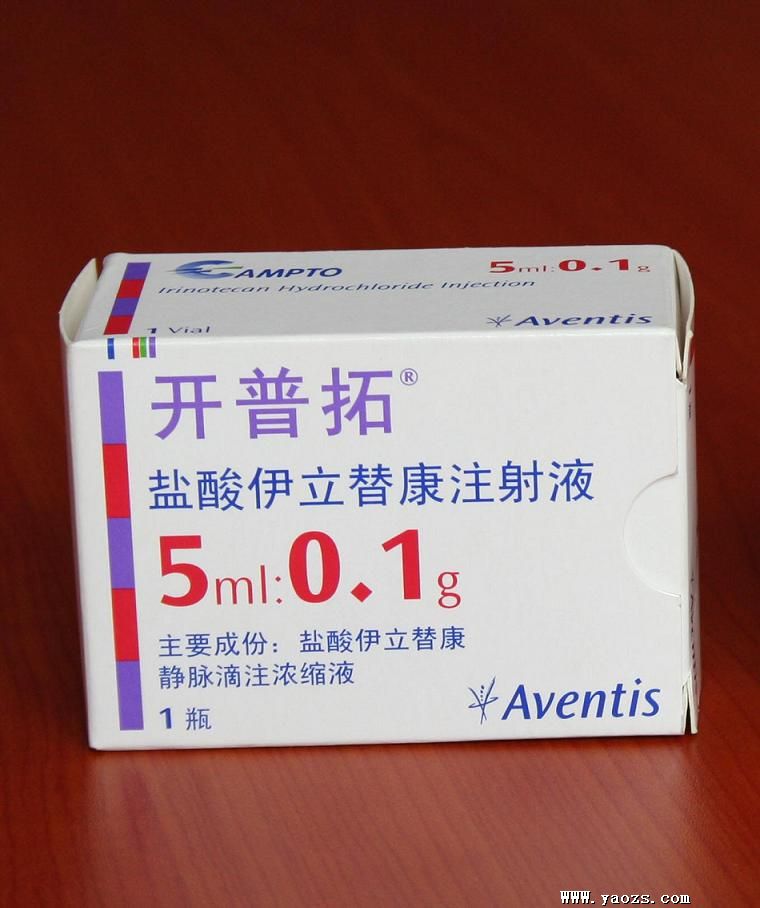
开普拓
【批准文号】注册证号H20030263
【药品价格】1600元
【药品名称】开普拓 盐酸伊立替康CPT-11
【生产厂家】英罗纳
【药物名称】开普拓 Irinotecan HydrochlOR ide Infusion
【药物别名】盐酸伊立替康 CPT-11
【分子式成分】开普拓.赋形剂的组成:山梨醇,乳酸和注射用水.溶液的pH值用氢氧化钠调到3.5.
【制剂规格】淡黄色澄明液体.赋形剂的组成:山梨醇,乳酸和注射用水.溶液的pH值用氢氧化钠调到35.开普拓(CAMPTO)40MG/2ML,含40mg盐酸伊立替康静脉滴注浓缩液,开普拓?(CAMPTO?)100MG/5ML,含100mg盐酸伊立替康静脉滴注浓缩液.
【药理毒理】药效学特性:抑制细胞生长的拓扑异构酶I抑制剂(L-抗肿瘤和免疫抑制剂).实验资料:伊立替康是半合成喜树碱的衍生物,是能特异性抑制DNA拓扑异构酶I的抗肿瘤药.它在大多数组织中被羧酸酯酶代谢为SN-38,而后者作用于提纯的拓扑异构酶I的活性比伊立替康更强,且对几种鼠和人肿瘤细胞系的细胞毒性也强于伊立替康.SN-38或伊立替康可诱导单链DNA损伤,从而阻断DNA复制叉,由此产生细胞毒性.这种细胞毒性是时间依赖性的,并特异性作用于S期.在体外实验中,并未发现伊立替康和SN-38可被P-糖蛋白MDR有效识别,且显示出对阿霉素和长春花碱耐药的细胞系仍有细胞毒作用.另外,在体内实验中,伊立替康对鼠肿瘤模型显示了广谱的抗瘤活性(PPO3胰导管腺癌,MA -16/C乳腺癌,C38和C51结肠腺癌)并有抗人异种移植肿瘤的活性(CO03胰导管腺癌,MA-16 /C乳腺癌,C38和C51结肠腺癌)并有抗人异种移植肿瘤的活性(Co-4结肠腺癌,MX-1乳腺癌,St-15和SC-6胃腺癌),伊立替康对表达P-糖蛋白MDR的肿瘤(长春新碱和阿霉素耐药的P3.88白血病)也有抗瘤活性.开普拓除具有抗肿瘤活性外,最相关的药理学作用为抑制乙酰胆碱酯酶.
【药动学】使用开普拓后,主要毒副作用的强度(如白细胞减少症和腹泻)与母体药物和其代谢产物SN -38的曲线下面积相关.在单药治疗中,血液学毒性(白细胞及中性粒细胞下降至最低点)或腹泻的程度与伊立替康和其代谢产物SN-38的曲线下面积值显著相关.伊立替康和SN-38(其活性代谢产物)的药代动力学特性在I期临床试验中进行了研究,60例患者接受了推荐剂量方案的药物治疗,即30分钟静脉滴注开普拓100-750mg/m2.伊立替康的动力学曲线是非剂量依赖性的.在临床试验中登记的患者接受不同伊立替康给药方案,其药代动力学均相似.其血浆代谢既是二室的又是三室的.三室模型中第一阶段的平均血浆半衰期为12分钟,第二阶段为2.5小时,最终阶段为14.2小时.在使用推荐剂量350mg/m2静滴结束时伊立替康和SN -38达到血浆峰浓度,分别为7.7μg/ml,56ng/ml,其曲线下面积分别为34μgh/ml,451 n gh/ml,其稳态分布容积很大,并保持相对稳定,为剂量的函数,平均为157L/m2.机体总清除率平均值为15L/h/m2,且在同一患者的不同周期保持稳定.SN-38在不同个体其药物代谢参数变化很大.伊立替康和SN-38.24小时平均尿排泄率分别为使用剂量的19.9%和0.25%.关于伊立替康药代动力学的II期临床试验在72例肿瘤患者中进行.限制采样模型计算出的药代动力学参数与I期研究的参数十分接近.体外实验中,伊立替康和SN-38的血浆蛋白结合率分别约为65%和95%.药代动力学资料表明5氟尿嘧啶/亚叶酸与伊立替康之间没有协同作用.
【适应证】晚期大肠癌患者的治疗.与5-氟尿嘧啶和亚叶酸联合治疗既往未接受化疗的晚期大肠癌患者,作为单一用药,治疗经含5-氟尿嘧啶化疗方案治疗失败的患者.
【不良反应】
对765例接受单药治疗,使用推荐剂量350mg/m2的患者,及145例接受联合治疗,使用开普拓推荐剂量180mg/m2,每2周给药一次,联合5-氟尿嘧啶/亚叶酸治疗的患者进行的研究表明,有一些不良反应可能与使用开普拓有关.胃肠道:迟发性腹泻:腹泻(用药24小时后发生)是开普拓的剂量限制性毒性反应.在单药治疗中:在所有听从腹泻处理措施忠告的患者中有20%发生严重腹泻.在可评估的周期内,14%出现严重腹泻.出现第一次稀便的中位时间为滴注开普拓后第5天.在联合治疗中:在所有听从腹泻处理措施忠告的患者中有13.1%发生严重腹泻.在可评估的周期内,3.9%出现严重腹泻.个别病例出现伪膜性结肠炎,其中1例已被细菌学证实(难辨梭状芽胞杆菌).恶心与呕吐:在单药治疗中,使用止吐药后约10%患者发生严重的恶心及呕吐.在联合治疗中,严重的恶心和呕吐发生率较低(分别为患者的2.1%和2.8%).其他胃肠反应:腹泻及/或呕吐伴随与腹泻及/或呕吐相关的脱水症状已有报导.可发生与开普拓及/或氯苯哌酰胺治疗有关的便秘.在单药治疗中有少于10%的患者发生.在联合治疗中有3.4%的患者发生.少见发生肠梗阻或胃肠出血报导报道.罕见肠穿孔.其他轻微反应如:厌食,腹痛及粘膜炎.血液学:中性粒细胞减少症是剂量限制性毒性.中性粒细胞减少症是可逆转和非蓄积的;无论在单药治疗或联合治疗中,到最低点的中位时间为8天.在单药治疗中:78.7%的患者均出现过中性粒细胞减少症,严重者(中性粒细胞计数